glossaire
(ncbi-gene reviews)
isoformes
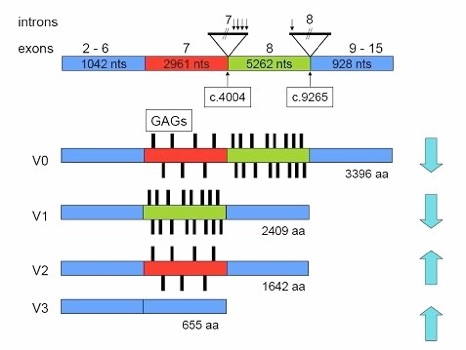
Produits protéiques issus de différentes versions d’ARN messager, créés à partir du même gène à l’aide de différents promoteurs, faisant sauter certains exons à la transcription. Comme les promoteurs sont spécifiques de certains tissus, différents tissus expriment différents produits protéiques du même gène.
ARN
synonyme:
acide ribonucléique
Molécule synthétisée à partir de la matrice ADN; contient le sucre ribose au lieu du désoxyribose présent dans l’ADN. Il existe trois types d’ARN: ARN messager (mRNA), ARN de transfert (tRNA) et ARN ribosomique (rRNA).
ADN
synonyme:
acide désoxyribonucléique
Molécule qui code les gènes responsables de la structure et du fonctionnement d’un organisme et permet la transmission d’informations génétiques de génération en génération.
gène
Unité de base de l’hérédité ; composé d’un segment d’ADN disposé selon une suite linéaire sur un chromosome. Un gène code une protéine ou un segment de protéine spécifique correspondant à une caractéristique ou à une fonction particulière.
transcription
Processus de synthèse de l’ARN messager (mRNA) à partir de l’ADN.
épissage
synonyme:
mutation d’épissage
Processus d’excision d’introns (parties non codantes) du transcrit primaire d’ARN messager et de jonction d’exons (parties codantes) donnant un ARN messager mature.
exon
Séquence codante d’ADN présente dans l’ARN messager mature.
nucléotide
Molécule composée d’une base azotée (adénine, guanine, thymine ou cytosine dans l’ADN; adénine, guanine, uracile ou cytosine dans l’ARN), d’un groupement phosphate et d’un sucre (désoxyribose dans l'ADN; ribose pour l'ARN). L’ADN et l’ARN sont des polymères de nombreux nucléotides.